Nature综述:从实验室到病房,干细胞疗法迎来关键转折点
点击蓝字 关注我们

前 言
你能想象吗?癌症、糖尿病、帕金森……这些困扰全球亿万人的疾病,正在被“细胞”重新改写命运。过去,我们谈干细胞,总觉得那是实验室里的未来学,如今,Nature 抛出一个惊人信号——全球已有超过100项临床试验,把干细胞放进了真正的病房考场。这不仅是科学的跨越,更是医疗模式的转弯:从“药物化学”到“细胞工程”,从“治标”到“重启机体功能”。那么,哪些病种最先受益?临床数据到底有多硬核?这场关乎生命修复的变革,距离你我还有多远?接下来,我们一层层剖开这扇“细胞走向诊所”的大门。
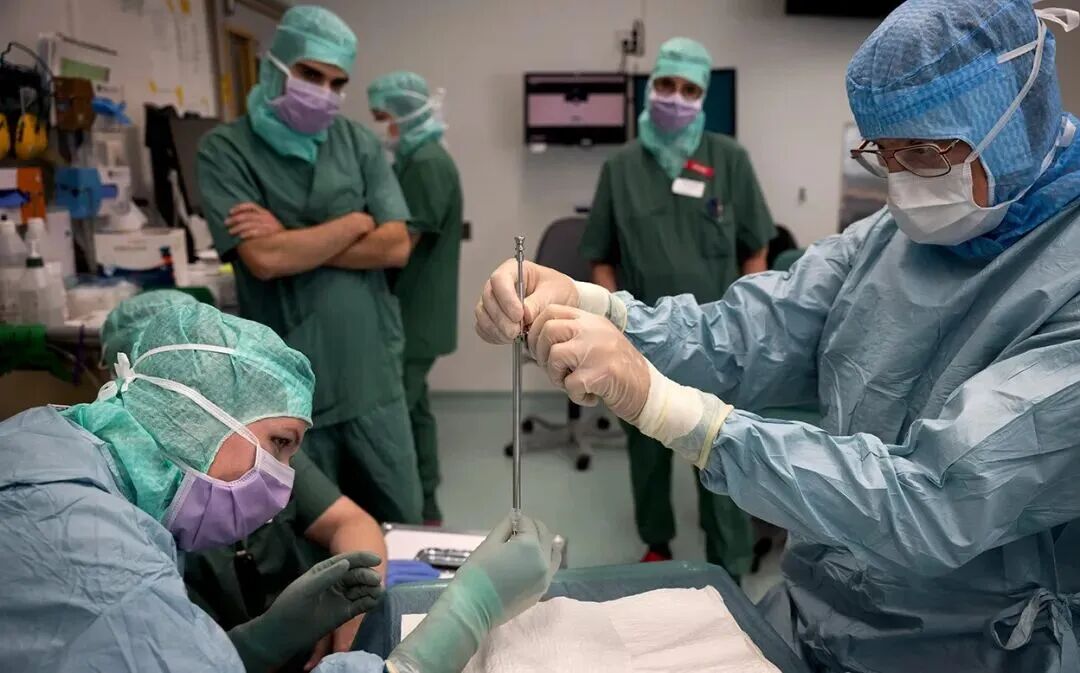
▲试验瑞典隆德斯科讷大学医院的一个团队准备了一根针头,将细胞移植到人的大脑中以治疗帕金森氏症
01 百项试验齐开:干细胞进入临床主战场
干细胞不再是孤立的科研项目,而是进入了跨国多中心临床试验的密集期。据Nature 2024年12月特写报道,目前全球已有100余项针对再生医学干细胞疗法的注册临床,涵盖癌症、糖尿病、帕金森等高负担疾病。
进入临床,意味着三重变化:
目标更明确——从笼统的“修复”转向精准靶向,例如针对帕金森病黑质区的多巴胺能神经元替换,或糖尿病患者缺失的胰岛β细胞补种。
评估更量化——影像学、生物标志物与功能评分相结合,让疗效“看得见、测得准”。
路径更清晰——监管机构(如FDA、EMA)为细胞与基因治疗开辟快速审评通道,缩短从临床试验到上市的时间。
尤其值得注意的是,临床试验的地理分布正在全球化——美国、加拿大、日本、韩国、欧洲各国都在开展Ⅱ/Ⅲ期关键性研究。这种广泛布局,不仅加速了证据积累,也为不同种族、遗传背景的适应症验证提供了天然条件。
换句话说,干细胞疗法正从“科学设想”进入“医疗验证”,而且验证的规模与速度,已经前所未有。
02 糖尿病:人造胰岛点燃内源性胰岛素
1型糖尿病(T1D)患者因为免疫系统破坏胰岛β细胞,失去了分泌胰岛素的能力,必须终身注射外源胰岛素。2025年6月,NEJM 发表了Vertex公司VX-880(zimislecel) Ⅰ/Ⅱ期试验数据(NCT04786262):14例受试者中,12例在输注一年后达到复合主要终点——无严重低血糖,HbA1c<7%或下降≥1%,且C-肽水平恢复,表明移植的干细胞-derived胰岛细胞已在患者体内正常产胰岛素;其中10例(83%)可停用外源胰岛素。
这一疗法的关键是:从多能干细胞分化出成熟的胰岛细胞,输注入肝门静脉,让其在肝脏中“安家”,重新接管血糖调节任务。更重要的是,这些细胞来自标准化培养,可实现批量生产与质量可控。
2024年,美国糖尿病协会年会公布的FORWARD研究同样显示:在全量输注组,患者血糖曲线明显趋稳,低血糖风险显著下降。VX-880被FDA授予突破性疗法认定(BTD),这意味着如果后续Ⅲ期数据稳定,可能在数年内进入上市审评。
对于T1D患者而言,这是一种从“替代治疗”到“功能恢复”的质变。
03 帕金森:补种多巴胺神经元,重启运动系统
帕金森病因黑质多巴胺神经元退化,导致震颤、僵直、运动迟缓。2025年4月,Nature 同日刊发两项关键临床:
bemdaneprocel(BRT-DA01):由人胚胎干细胞(hESC)分化成多巴胺前体细胞,植入帕金森患者双侧纹状体。在Ⅰ期(NCT04802733)中,患者在18个月随访内维持安全性良好,PET显像显示多巴胺摄取增加。
京都大学CiRA的iPSC方案:使用诱导多能干细胞来源的多巴胺前体,在jRCT2090220384试验中,高剂量组^{18}F-DOPA摄取↑45%,无肿瘤形成,功能评分改善显著。
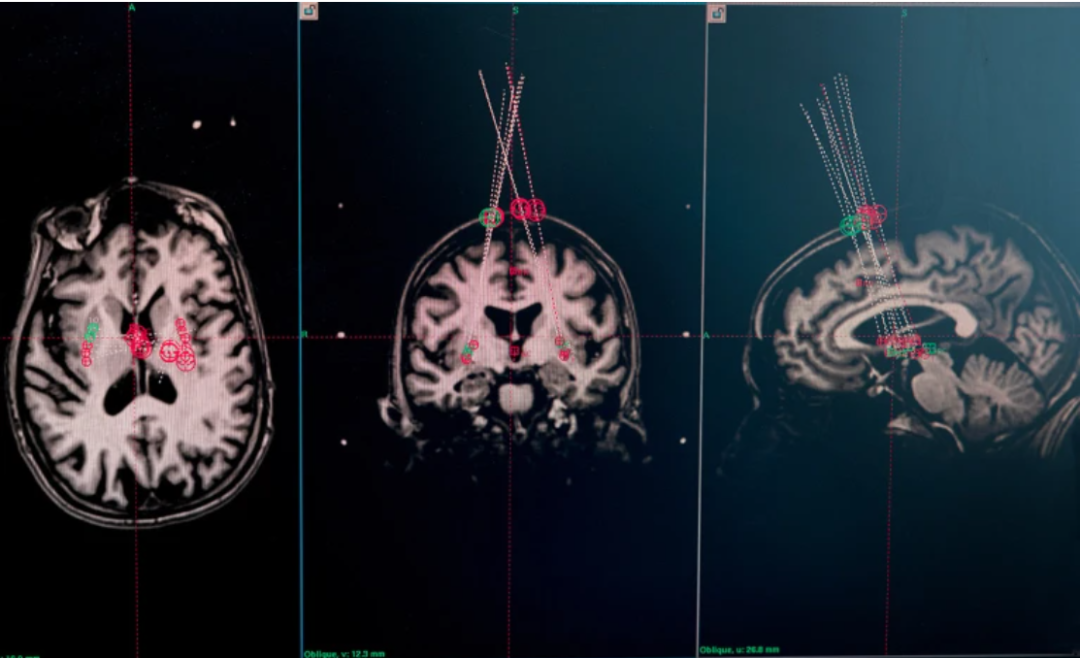
▲试验参与者的脑部 MRI 扫描用于计划针头将细胞输送到何处
两种技术路线各有优势:hESC细胞来源稳定,便于规模化;iPSC则来自患者自体细胞,免疫排斥风险较低。
更重要的是,这些移植不仅“存活”,还功能性产多巴胺,相当于在患者大脑中“重建工厂”。这为帕金森病的治疗带来可能的“疾病修正”,而不只是对症缓解。
04 癌症与遗传血病:造血干细胞的“基因重装”
造血干细胞(HSC)可作为“运载工具”,将基因编辑成果植入机体,实现长期治疗。2023年12月,FDA 批准了两款HSC基因疗法:CASGEVY(exa-cel) 与LYFGENIA(lovo-cel),用于镰状细胞病(SCD)患者。
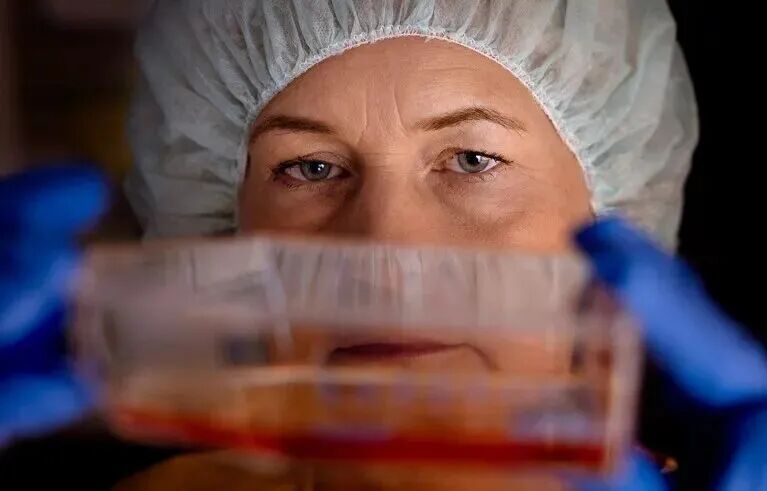
▲瑞典隆德大学的 Malin Parmar 实验室为一项正在进行的试验开发了干细胞来源的替代细胞,该试验试图使用干细胞疗法来替换帕金森病患者的受损组织。
exa-cel 采用CRISPR/Cas9技术,切割抑制胎儿血红蛋白的BCL11A基因调控区,让患者终身生产胎儿血红蛋白,从而缓解SCD症状。NEJM 2024数据显示,97%患者在≥12个月随访中无血管阻塞危象(VOC)。
lovo-cel 使用慢病毒载体导入正常β-珠蛋白基因,恢复正常血红蛋白合成。
这些方案的本质是“一次性造血干细胞重装”——取出患者骨髓干细胞,体外基因改造后回输,骨髓中从此产出“健康血液”。
这类模式在血液肿瘤(如多发性骨髓瘤)及免疫系统重建中同样可扩展应用,未来可能形成细胞+基因治疗的复合平台。
05 用细胞修复细胞,用生命修复生命
干细胞疗法正在完成从“科研名词”到“临床日常”的跨越。糖尿病的人造胰岛、帕金森的神经元补种、遗传血病的基因重装——这些都已进入真实的患者试验,并交出了令人信服的早期成绩单。它们不是神话,而是被注册号、临床终点、监管审批节点反复验证的医学进步。
Nature 用“turning point”形容这一刻——这不只是技术转折,更是医疗哲学的转折:用细胞修复细胞,用生命修复生命。或许不久之后,干细胞不再被称为“未来医学”,而是被写进医院的处方笺。
参考文献
Stem cells head to the clinic: treatments for cancer, diabetes and Parkinson’s disease could soon be here


本公众号所有文章旨在宣传生命科学领域的最新技术和研究,所有内容均不构成任何医疗指导。

本篇文章来源于微信公众号:中启源生物科技







