细胞科普|干细胞外泌体+磁驱技术:让深度创面愈合提速52%,胶原提升110%,炎症下降85%!
点击蓝字 关注我们

前 言
你可能以为,干细胞治疗的核心是“移植细胞”——让它们在体内生根发芽,修复受损组织。可最新研究告诉我们,真正的“主力军”其实是干细胞分泌的外泌体(Exosomes)。
这些直径仅 30~150 纳米的小囊泡,就像快递包裹,装满了修复信号分子,能跨越细胞与细胞的距离传递再生指令。
然而,要让外泌体深入伤口深处并持续发挥作用,却并不容易:纤维蛋白血栓、痂皮、炎症屏障会阻挡它们的进入。
南方医科大学等团队在 2025 年发表于 Nature Communications的最新成果中,用一种“磁驱微马达”为外泌体组建了一支能深入战场的“舰队”,在小鼠与猪的实验中,让深度创面愈合速度翻倍。这不仅是一次技术融合,更是外泌体疗法的跨越式升级。
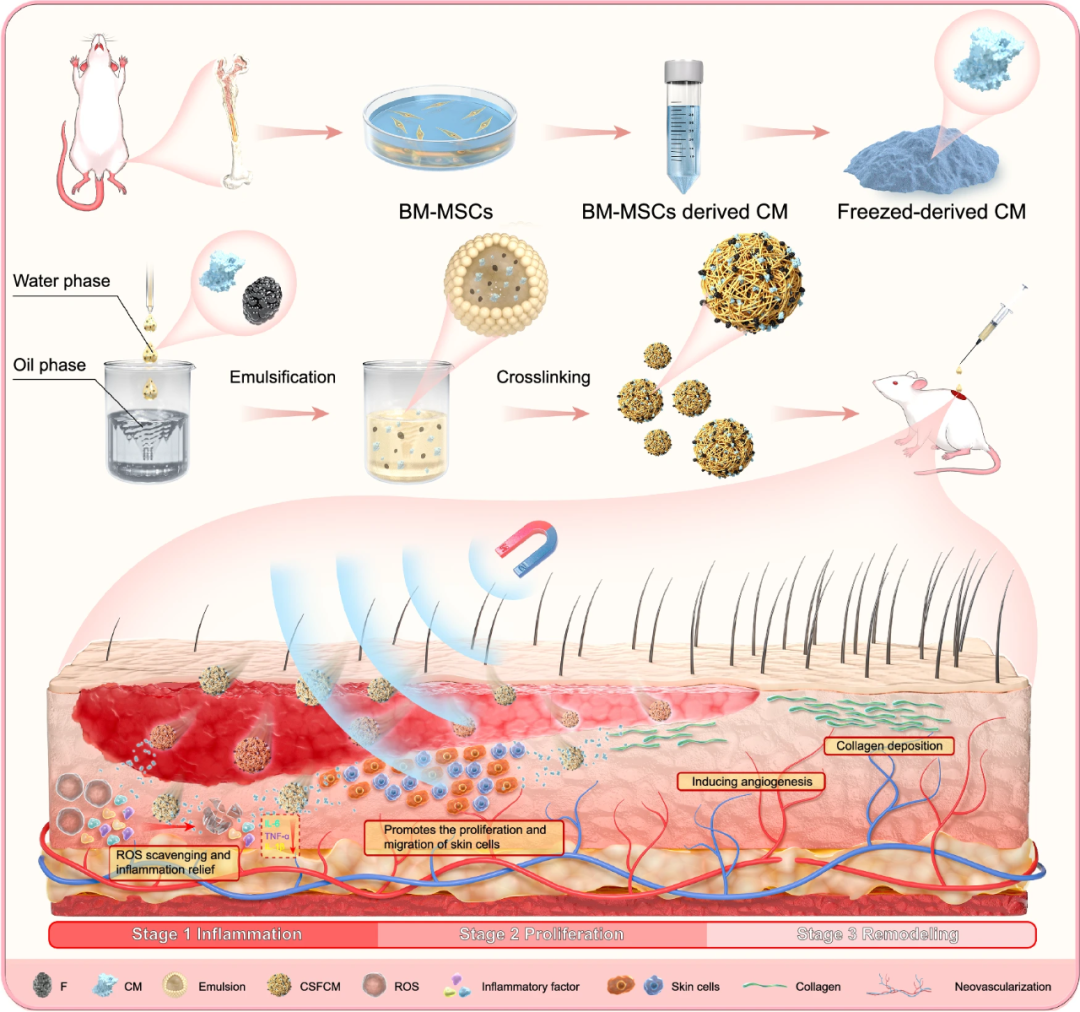
▲用于时空优化伤口愈合的 CSFCM + M微电机示意图
01 权威证据:外泌体递送的深度突破
外泌体因富含 microRNA、蛋白质、脂质等活性分子,被称为干细胞疗法的“核心效应单位”。但在复杂创面中,它们往往被卡在表层,难以触达缺血、炎症持续的深部组织。
本研究中,团队将间充质干细胞(MSC)外泌体冷冻干燥后,封装在壳聚糖磁性微球(CSFExos)内,形成具备磁响应性的“外泌体舰队”(CSFExos+M)。
数据亮点:
递送效率:在模拟血栓模型中,磁驱组外泌体信号强度是无磁组的 2.23 倍。
释放曲线:外泌体可持续释放 6 天,累计释放量达 89.72%,避免了“一次性爆发”后迅速衰减的弊端。
小鼠全层皮肤缺损实验:第13天伤口缩小率比无磁组高 52.02%,表皮厚度下降 51.07%(更接近正常皮肤),胶原含量提升 110.39%。
巴马小型猪模型:第28天伤口完全闭合,胶原密度比对照组高 91.05%。
这意味着,外泌体不仅“进得去”,而且能在创面不同愈合阶段持续释放信号,显著提升组织再生的质量与速度 。
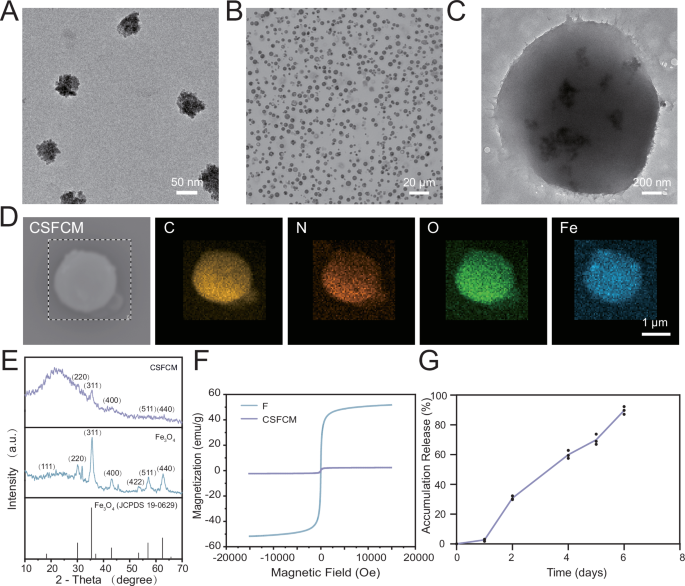
▲CSFCM的特征
02 机制揭秘:磁驱外泌体如何“冲锋陷阵”
外泌体是细胞间通讯的“信使”,但它们的天然扩散路径在深部创面中受限。本研究的突破在于给外泌体“配备动力系统”:
载体结构:壳聚糖–Fe₃O₄ 磁性微球,具备优异的生物相容性、正电荷抗菌能力,并可响应外部磁场。
货物核心:MSC 外泌体,含血管生成因子(VEGF-A:350.84±8.98 pg/mL)、抗炎因子(TGF-β等),以及多种修复相关 microRNA。
驱动方式:外部旋转磁场让微球发生倾斜轴旋转,转化为推进力;多颗微球可链状组装,产生机械扰动以破开纤维网络。
工作流程:
1、定向渗透:磁场控制“舰队”深入创面裂隙,突破血栓/痂皮屏障。
2、按节奏释放:外泌体缓释覆盖炎症期、增殖期到重塑期的全周期。
3、双重作用:机械穿透+外泌体信号传递同步进行,实现空间与时间的双精准。
这种方法的关键,不只是“送到位”,更是“送得准、送得久”——外泌体的修复指令因此能在最佳时机被伤口细胞接收 。
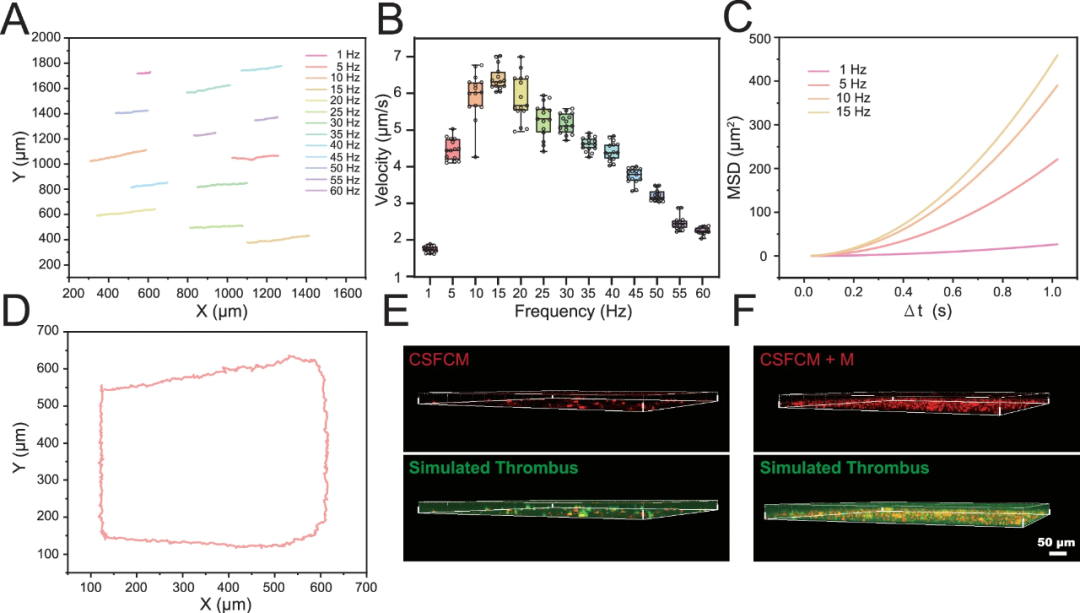
▲CSFCM+M的运动行为
03 潜在应用:从糖尿病足到烧伤治疗
这项磁驱外泌体技术的应用潜力极广:
1、慢性难愈合伤口:糖尿病足、静脉溃疡患者的伤口常年处于低灌注、高炎症状态,外泌体的血管生成与抗炎信号,配合磁驱递送,可突破坏死组织阻挡。
2、烧伤与深切口术后修复:大面积创伤需要抑制炎症同时重建真皮结构。研究显示,小鼠模型中 IL-6、TNF-α 分别下降 82.23%和 85.27%,胶原沉积更有序,疤痕减少。
3、多功能治疗平台:外泌体可与抗生素、siRNA、抗纤维化药物共同封装,实现一体化、多靶点治疗。
4、可穿戴/敷料结合:磁控系统可与智能敷料融合,通过可穿戴磁场发生器进行家庭化治疗。
安全性方面,壳聚糖与 Fe₃O₄ 微球表现出低溶血率(<1.5%),动物主要脏器无明显病理损伤,这为临床转化奠定了基础 。
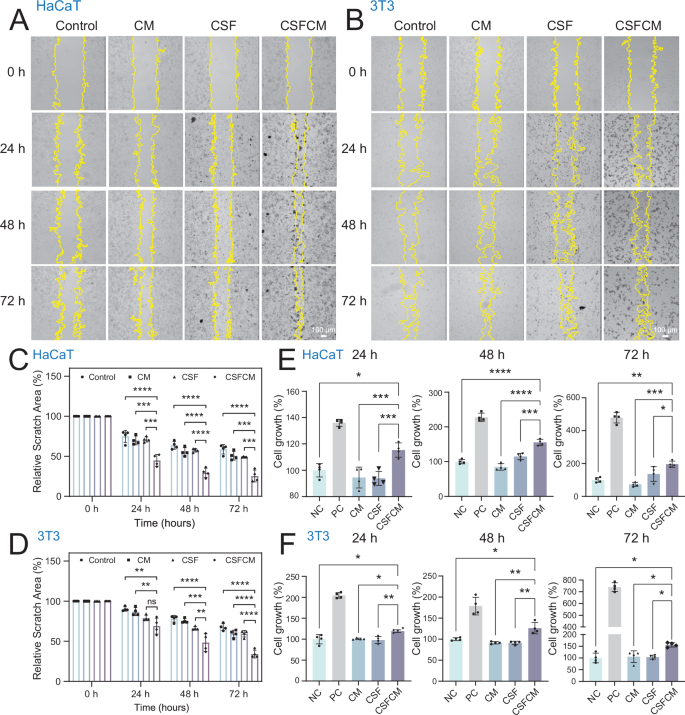
▲CSFCM对皮肤细胞迁移和增殖的影响
04 趋势与意义:外泌体疗法的升级范式
在再生医学领域,外泌体疗法(Cell-free therapy)正逐渐取代部分干细胞直接移植的场景,原因包括:
无细胞存活与免疫排斥风险
更易标准化生产与储运
药理作用机制更可控
这项研究的意义在于,它把外泌体的化学信号与磁控递送的物理能力结合起来,解决了两个瓶颈:
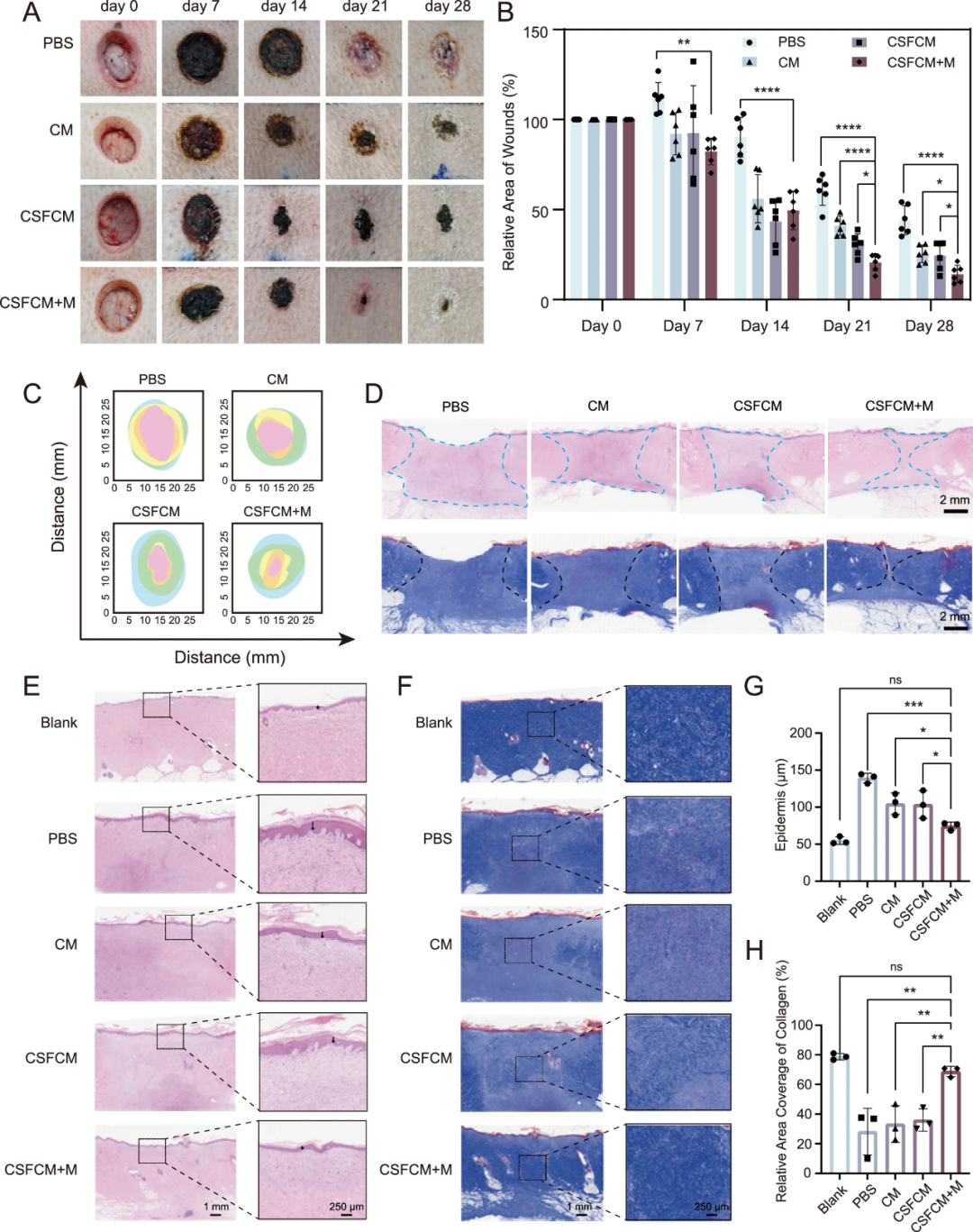
▲CSFCM+M 加速全层猪皮肤伤口模型中的伤口愈合
1、时序精准——缓释系统覆盖整个愈合周期,避免一次性释放导致的信号浪费。
2、空间精准——磁驱动突破创面屏障,把外泌体送到真正需要的微环境。
国际上,美国哈佛大学、德国马克斯·普朗克研究所等团队已在外泌体与纳米载体融合方向投入研究,但大多停留在静态渗透阶段。
这项跨物种验证的成果,直接将外泌体递送推进到“可控、可导航、可持续”的新阶段,也为外泌体产业化提供了新模式:外泌体+主动递送。未来,这类技术不仅能用于皮肤伤口,还可能应用于脑损伤、心肌梗死甚至肿瘤治疗 。
05 结语
外泌体曾被认为是干细胞疗法的“配角”,而这项磁驱递送技术让它成为了创面修复的“主将”。在小鼠和猪的实验中,这支外泌体舰队能精准穿透伤口屏障、按需释放修复信号,让深度创面愈合速度和质量双提升。
它的意义,不仅在于治好难愈的伤口,更在于证明了外泌体疗法可以通过工程化手段跨越物理限制,走向更精准、更智能的方向。
或许在不远的未来,我们不再只是被动等待伤口自愈,而是能主动调度一支可导航的外泌体舰队,在身体深处完成一次又一次的“隐形修复战”。
参考资料
Jiang, J., Liang, H., Ye, Y. et al. Stem cell secretome armed magneto-actuated micromotors as spatio-temporal manipulators for wound healing acceleration. Nat Commun 16, 6754 (2025). https://doi.org/10.1038/s41467-025-61914-8


本公众号所有文章旨在宣传生命科学领域的最新技术和研究,所有内容均不构成任何医疗指导

本篇文章来源于微信公众号:中启源生物科技







